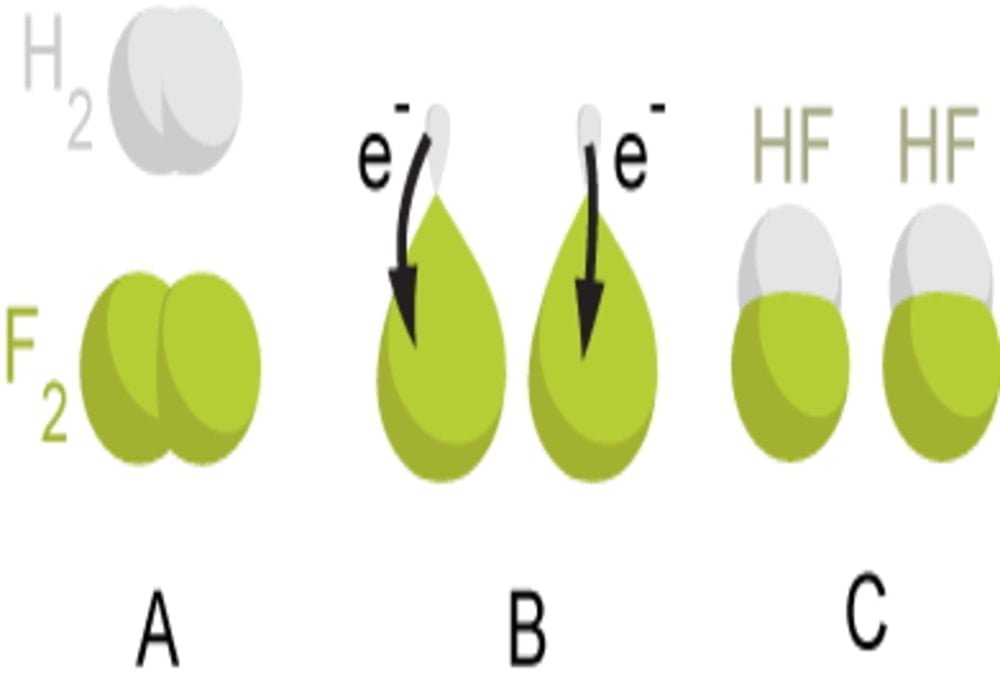
Pengertian rumus contoh soal april 16 2020 by eka reaksi redoks oksidasi reduksi merupakan proses proses elektrokimia dimana reaksinya melibatkan hubungan antara listrik dan reaksi kimia. Reaksi redoks reduksi dan oksidasi contoh soal aplikasi bilangan oksidasi kimia selain reaksi penggabungan reaksi penguraian dan reaksi metatesis masih terdapat satu jenis reaksi yang penting yaitu reaksi reduksi oksidasi redoksreaksi ini memiliki aplikasi yang sangat penting sebab merupakan reaksi kimia yang menghasilkan energi listrik siap pakai seperti pada baterai dan aki.

Reaksi Reduksi Oksidasi Elektrokimia Ardra Biz
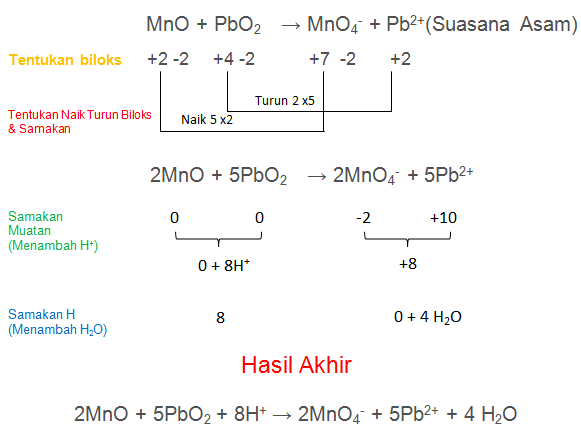
Contoh soal reaksi oksidasi. Oksidasi adalah menjelaskan pelepasan suatu elektron pada sebuah molekul atom atau ion ion. Istilah redoks berasal dari kata reduksi dan oksidasi. Contoh soal penyetaraan reaksi redoks dan jawaban kelas 12 sma reaksi redoks merupakan reaksi yang melibatkan reaksi reduksi dan reaksi oksidasi. Bagi reaksi menjadi 2 satu reduksi dan satu oksidasi. Jumlah suatu bilangan oksidasi unsur unsur dalam senyawa ialah 0 nol. Samakan jumlah atom h dengan menambahkan h suasana asam atau oh suasana basa.
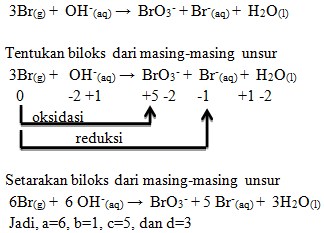
Suatu reaksi tergolong reaksi redoks atau bukan dapat dilakukan dengan mengecek bilangan oksidasi masing masing atom tiap senyawa yang terlibat dalam reaksi. Biloks ag mengalami penurunan dari 1 menjadi 0 sedangkan biloks c mengalami kenaikan dari 0 menjadi 2. Untuk lebih jelasnya perhatikan 5 contoh soal reaksi redoks dan pembahasannya berikut ini. Contoh soal bilangan oksidasi. Pengertian reaksi oksidasi dan reaksi reduksi berkembang sesuai dengan perkembangan ilmu kimia. Berikut adalah contoh soal reaksi oksidasi reduksi dan redoks.
Reaksi redoks adalah perubahan pada suatu bilangan oksidasi atau keadaan oksidasi atom atom pada sebuah reaksi kimia. Tentukan oksidator reduktor hasil oksidasi dan hasil reduksi pada masing masing reaksi be. Reaksi disproporsionasi adalah reaksi redoks dimana yang bertidan sebagai oksidator dan reduktor adalah zat yang sama. Jadi sebagian darireaksi ini mengalami oksidasi dan sebagian lagi mengalami reduksiyang mengalami reaksi disproporsionasi adalah 3i 2 s 6 koh aq à 5 ki aq kio 3 aq 3h 2 o l dimana zat yang bertindak sebagai oksidator dan reduktor adalah i 2. Samakan jumlah unsur yang berubah biloks. Reaksi di atas tergolong reaksi oksidasi karena terjadi pelepasan elektron dan kenaikan bilangan oksidasi dari 0 menjadi 2.
Reaksi redoks adalah suatu reaksi yang didalamnya terjadi oksidasi dan reduksi. Jumlah pada bilangan oksidasi unsur unsur pembentuk ion poliatom adalah sama dengan muatan ion poliatomnya tersebut. Cara ii metode setengah reaksi. Reaksi reduksi dan reaksi oksidasi banyak terjadi dalam kehidupan sehari hari misalnya reaksi. Samakan jumlah atom o dengan menambahkan h 2 o di yang kurang o sebanyak kekurangannya suasana asam atau menambahkan h 2 o di yang lebih o sebanyak kelebihannya suasana basa. Ag 2 os cs 2ags cog reaksi tersebut merupakan reaksi redoks karena jika dilihat bilangan oksidasinya jelas terjadi perubahan biloks.
Bilangan oksidasi unsur o pada h 2 o koh h 2 so 4 dan na 3 po 4 ialah 2.