1 h 1. Contoh senyawa kovalen polar yaitu hcl hbr hi hf h 2 o dan nh 3contoh senyawa kovalen nonpolar yaitu h 2 o 2 n 2 cl 2 ch 4 c 6 h 6 dan bf 3.
Kovalen Polar
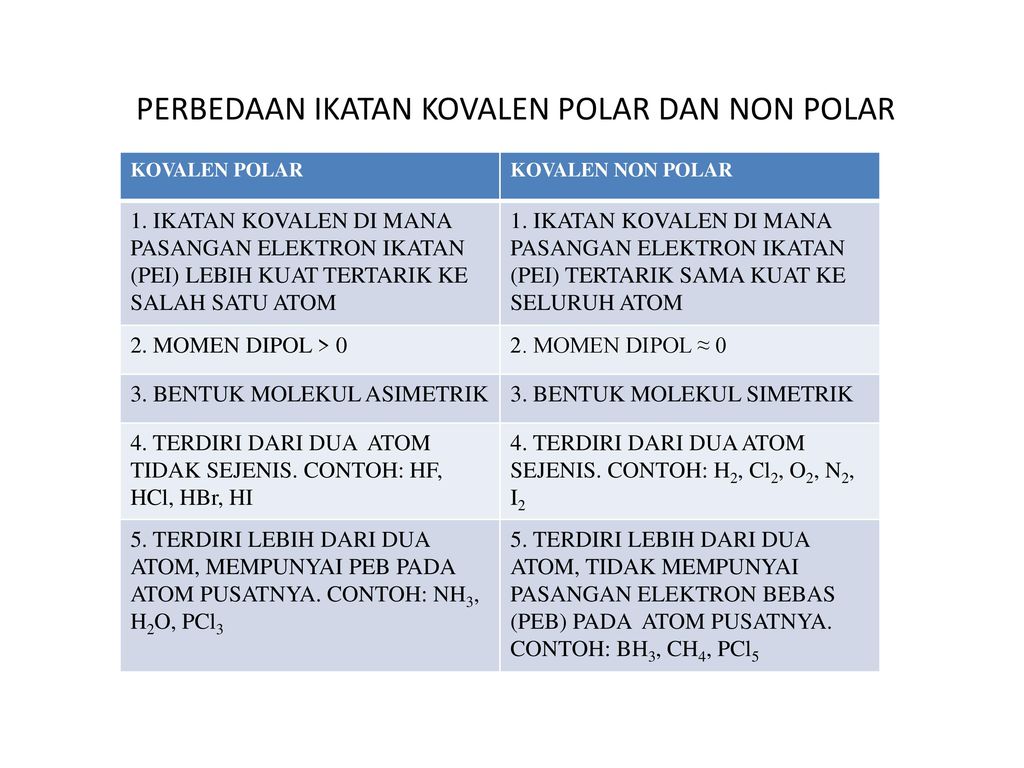
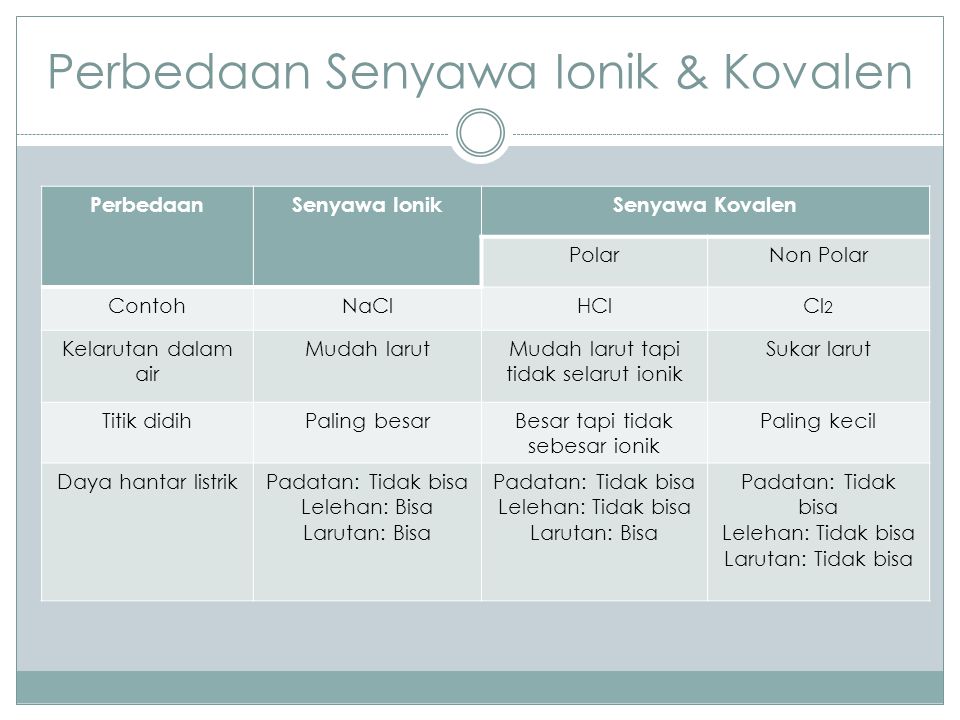
Contoh senyawa kovalen polar. Contoh ikatan kovalen polar. Metana adalah contoh dari senyawa kovalen. Dalam hal ini untuk dapat membedakan kedua senyawa berikut ini yakni senyawa polar dan non polar yang dapat ditunjukan dari beberapa sisi yang diantaranya dari ciri senyawa distribusi elektronnya dan ukuran kuantitatif titik didih. Semoga artikel ini dapat membantu dan menambah wawasan sobat semuanya. Dlm senyawa hf ini f mempunyai keelektronegatifan yang tinggi jika dibandingkan h. Senyawa kovalen dikatakan non polar jika senyawa tersebut tidak memiliki perbedaan keelektronegatifan.
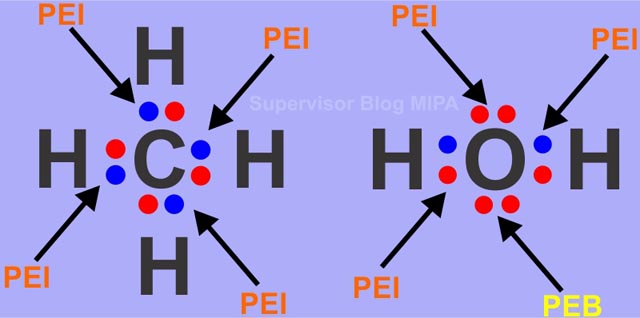
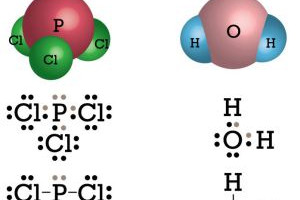
Dan salam chemistry. Contoh senyawa kovalen non polar h2 n2 cl2 br2 i2 ch4 ccl4 bcl3 no2 sf6 bf3 co2 dll ok beitulah penjelasan mas dennis mengenai pengertiansifat dan contoh dari senyawa kovalen. Dengan demikian pada senyawa yang berikatan kovalen tidak terjadi pengutuban muatan. Ikatan antara 1 h dengan 53 i. Ini adalah ikatan kimia dengan atom berbagi elektron valensi. Perhatikan struktur lewis untuk senyawa pcl 3 dan h 2 o berikut.
Ikatan kovalen nonpolar adalah ikatan kovalen yang terbentuk ketika atom membagikan elektronnya secara setara sama. Karena terdapat perbedaan keelektronegatifan maka senyawa hi termasuk senyawa polar. Contoh ikatan kovalen polar dan non polar proses pembentukan pengertian soal kunci jawaban kepolaran senyawa unsur kimia pernahkah anda melihat air dengan minyak tidak bercampur satu sama lain. Senyawa polar dan non polar pengertian ciri kovalen perbedaan sifat titik didih contoh. Karena tidak terdapat perbedaan keelektronegatifan maka senyawa o 2 termasuk senyawa nonpolar. Ikatan kovalen nonpolar adalah ikatan kovalen yang pasangan elektron ikatannya pei tertarik sama kuat ke arah atom atom yang berikatan.
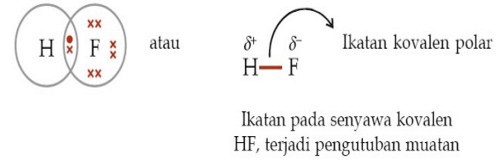
Sehingga pasangan elektron lebih tertarik kearah f akibatnya akan terbentuk dipol dipol atau terjadi pengkutuban terbentuknya kutub antara h dan f. Air dan minyak merupakan suatu senyawa kovalen yang memiliki kepolaran berbeda. Dalam senyawa kovalen atom dari unsur unsur yang berbeda ada di dalam molekul oleh ikatan kovalen. 8 o 2 6. Senyawa kovalen dikatakan non polar jika senyawa tersebut tidak memiliki perbedaan keelektronegatifan. Ikatan kovalen nonpolar adalah ikatan kovalen yang pasangan elektron ikatannya pei tertarik sama kuat ke arah atom atom yang berikatansenyawa kovalen nonpolar terbentuk antara atom atom unsur yang mempunyai beda keelektronegatifan nol atau mempunyai momen dipol 0 nol atau mempunyai.
Contoh ikatan kovalen polar hf. Contoh senyawa kovalen polar adalah nh 3pcl 3 h 2 o dan cl 2 o. Bagaimana suatu ikatan kovalen suatu senyawa dapat mempengaruhi kepolaran. Senyawa yang terbentuk dari dua atau lebih unsur non logam seperti karbon dan hidrogen yang disebut senyawa kovalen. Ikatan kovalen non polar. 53 i 2 8 18 18 7.