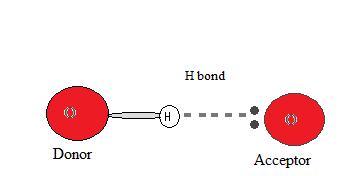
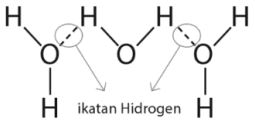
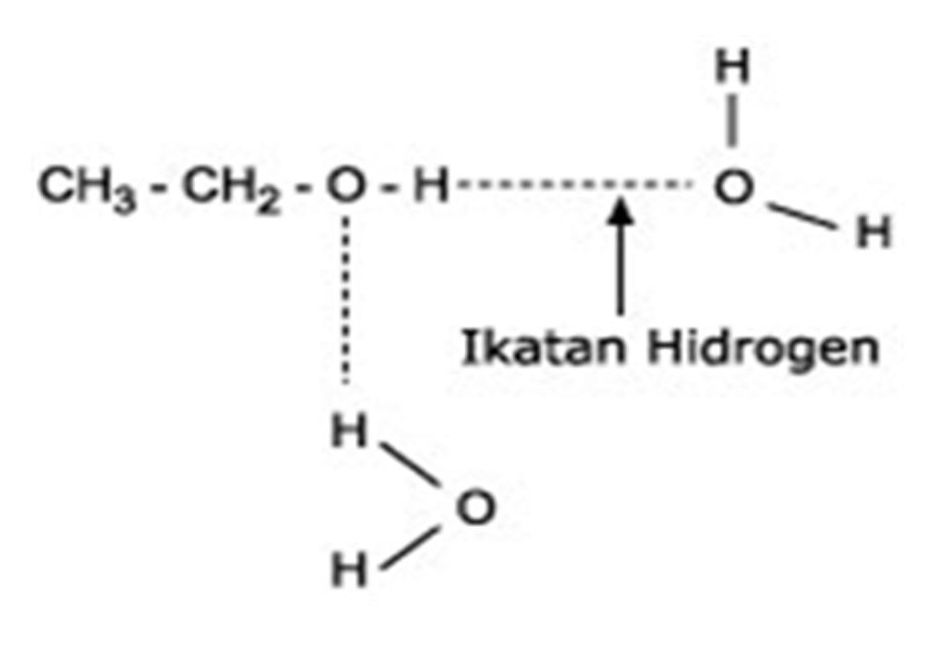
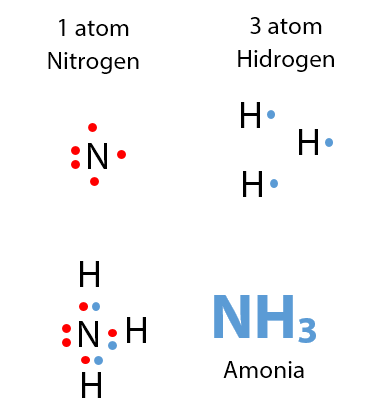
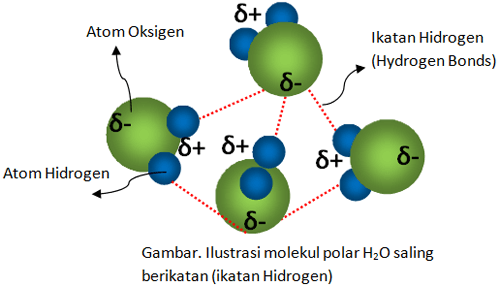
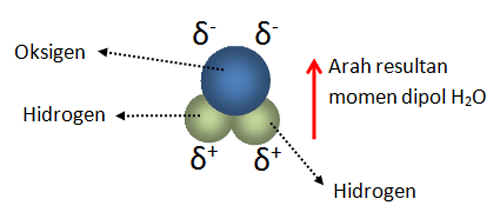
Atom hidrogen membentuk ikatan yang lemah dengan atom elektronegatif dari molekul lain dan ikatan lemah tersebut disebut ikatan hidrogen. Bukti adanya ikatan hidrogen.

Pengertian Ikatan Kimia Jenis Contoh Ikatan Kimia
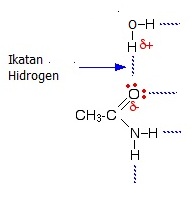
Contoh senyawa ikatan hidrogen. Ikatan hidrogen adalah ikatan tambahan berupa daya tarik listrik antara atom hidrogen dengan unsur elektronegtif sedangkan kedua atom ini sedang berikatan kovalen dengan atom lain. Etana merupakan hidrokarbon yang lebih terperinci pada sebuah alkana terdiri dari dua atom karbon bersatu pada sebuah ikatan tunggal masing masing berikatan pada tiga atom karbon. Adanya ikatan hidrogen membuat titik didih suatu senyawa menjadi lebih tinggi. Lalu seperti apa apa itu contoh ikatan hidrogen dibahas dengan jelas disini semoga bermanfaat. Ikatan hidrogen pada h2o dan nh3. Ikatan kimia adalah proses fisika yang bertanggung jawab dalam interaksi gaya tarik menarik antara dua atom atau molekul yang menyebabkan suatu senyawa diatomik atau poliatomik menjadi stabil.
Contoh ikatan hidrogen adalah topik yang kami ulas. Contoh soal ikatan hidrogen. Ikatan hidrogen dalam satu molekul sering terjadi pada senyawa organik yang misalnya yang mengandung dua gugus oh dengan jarak yang tidak terlalu jauh misalnya asam oksalat h 2 c 2 o 4. Senyawa yang hanya mengandung ikatan kovalen disebut senyawa kovalen. Berikut ini merupakan beragam contoh soal dan jawaban atas ikatan hidrogen antara lain. Contoh pada metana gas rawa yang merupakan hidrokarbon dengan satu atom karbon dan memiliki empat atom hidrogen.
H2o co2 dan lain lain. Penjelasan mengenai gaya tarik menarik ini sangatlah rumit dan dijelaskan oleh elektrodinamika kuantum. Kekuatan ikatan hidrogen dalam molekul molekul secara berurutan adalah h 2 o hf nh 3penyimpangan titik didih nh 3 hf dan h 2 o dalam hubungannya dengan titik didih senyawa senyawa kovalen hidrida dari unsur. Ikatan kovalen umumnya terjadi antara atom atom unsur nonlogam bisa sejenis contoh. H2 n2 o2 cl2 f2 br2 i2 dan berbeda jenis contoh. Ikatan ionik hanya dapat terjadi antara kation dan anion sederhana senyawa ionik hanya dapat terbentuk secara langsung dari ion ion dll.
Namun ketika senyawa tersebut bersifat non polar maka air tidak mampu melarutkan senyawa tersebut karena tidak adanya ikatan hidrogen yang terbentuk. Menurut wibowo 2013 ada beberapa yang perlu diperhatikan biasanya terjadi kesalahan konsep dalam materi ikatan kimia ini seperti contoh sebagai berikut. Bukti adanya peran ikatan ini yang mana cukup signifikan adalah perbandingan sifat fisik titik didih abnormal dari senyawa senyawa nh 3 hf dan h 2 o. Sifat sifat ini menunjukkan bahwa adanya gaya antar molekul tak lazim yang kuat pada molekul molekul ketiga senyawa tersebut yakni ikatan hidrogen. Sebagai contoh ikatan hidrogen terdapat pada antar molekul h 2 o dan antar molekul nh 3 seperti yang ditunjukkan dalam gambar berikut. Di dalam prakteknya para kimiawan biasanya bergantung pada teori kuantum atau penjelasan.
Ikatan hidrogen terbentuk pada senyawa senyawa polar yang mengandung atom h dan atom yang memiliki keelektronegatifan tinggi seperti f o n dan cl. Diantara senyawa berikut manakah yang memiliki titik didih paling tinggi. Pada formula atau rumus ionik.