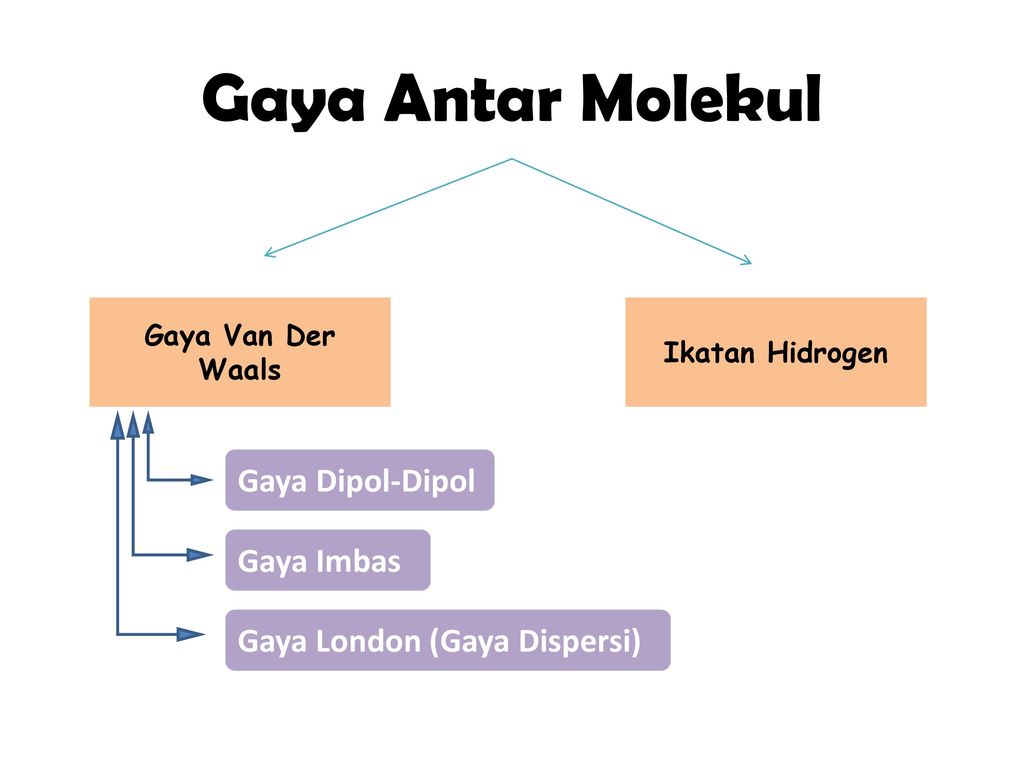
Dalam satu golongan dari atas ke bawah unsur memiliki gaya van der walls yang semakin bertambah sebanding dengan bertambah besarnya mr. Gaya london sering juga disebut dengan gaya tarik menarik dipol terimbas.
Kimia Gaya Van Der Waals
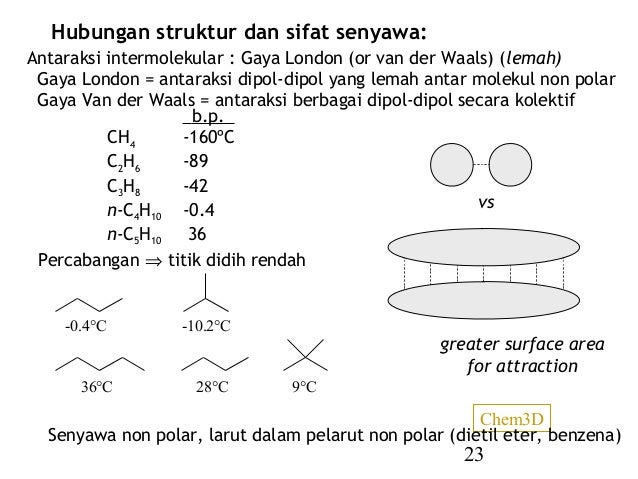
Contoh senyawa gaya london. Kekuatannya 1 sampai 10 kjmol. Meskipun demikian gaya ini amat penting karena tanpa adanya gaya london senyawa senyawa nonpolar tidak mungkin dapat dicairkan dan dipadatkan. Gaya london menyebabkan senyawa nonpolar dapat berkondensasi. Titik didih senyawa sebanding sekaligus mencerminkan kekuatan gaya london. Gaya van der waals. Gaya yang memengaruhi titik didih senyawa unsur hidrida golongan iva va via viia dan viiia adalah gaya van der walls.
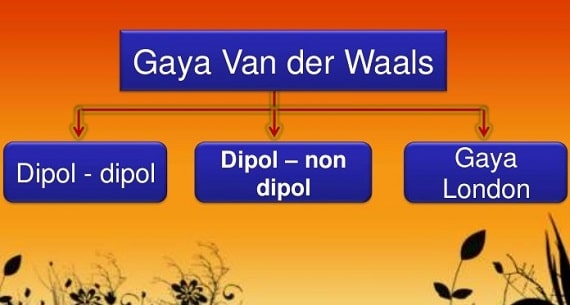
Sebagai akibat yang seharusnya titik didih dari atas ke bawah dalam satu golongan semakin bertambah. Namun untuk senyawa ion pengaruhnya bisa dibilang sangat kecil jika dibandingkan dengan gaya tarik menarik yang terjadi antar ion. Gaya london merupakan gaya intermolekuler yang paling lemah. Gaya london merupakan gaya yang lemah. Gaya antar molekul selanjutnya adalah gaya van der waals. Sebagai contoh molekul air h 2 o yang bersifat polar dapat menginduksi molekul oksigen o 2 yang bersifat nonpolar.
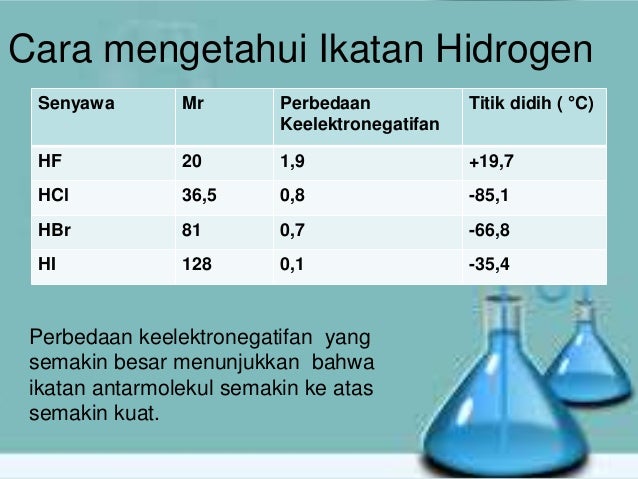
Gaya london terjadi di semua partikel. Terjadinya dipol terimbas 2. Teori mekanika kuantum gaya dispersi. Nama gaya ini diambil dari nama seorang ilmuwan yaitu. Senyawa senyawa hidrida dari golongan va via dan viia secara umum juga mengikuti pola kenaikan titik didih yang sama namun khusus untuk senyawa nh 3 h 2 o dan hf titik didihnya jauh lebih tinggi dari yang diperkirakan. Interaksi dipol terimbas dipol terinduksi gaya antarmolekul ini terjadi saat molekul polar mengimbas menginduksi molekul nonpolar.
Pengertian gaya london gaya dispersi london adalah gaya tarik menarik sementara yang dihasilkan ketika elektron dua atom yang berdekatan menempati posisi yang membuat atom membentuk dipol sementara. Hal ini dapat dimengerti sebagai akibat dari adanya polarisabilitas dan gaya dispersi london secara umum meningkat seiring dengan bertambahnya massa molekul.